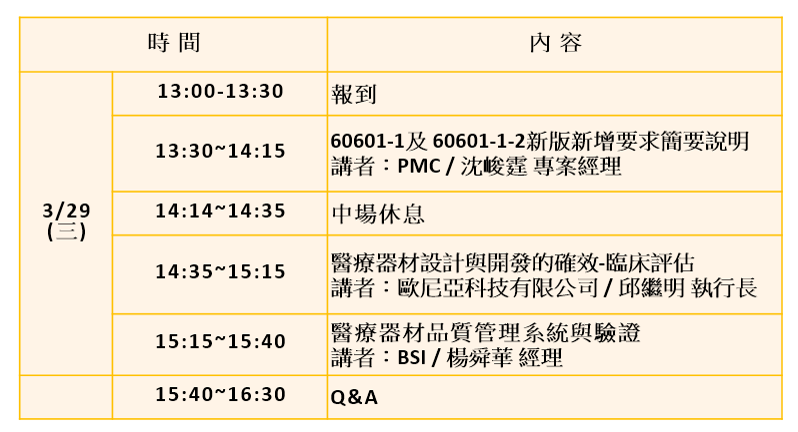
課程目的
依據 ISO 13485:2016品質管理系統設計與開發確效7.3.7要求, 組織應依據適用之法規對該醫療器材進行臨床評估或性能評估, 以歐盟醫療器材法規 (MDR) 為例,在 Article 10 (General obligations of manufacturers) 要求製造廠要執行臨床評估,這將會對醫材廠要符合MDR要求上決定性的門檻與挑戰。本研討會將說明MDR在醫材品質管理系統、臨床評估及醫電產品60601-1/ 60601-1-2標準新舊要求差異,敬邀業界貴賓蒞臨指導。
【注意事項】
1.因應衛生安全考量,出席本活動者請全程配戴口罩。
2.本活動不另提供紙本講義與電子檔,謝謝。